國產新冠口服藥VV116三期臨床研究傳來喜訊,將進入上市申請階段
記者今天獲悉,上海企業君實生物與蘇州企業旺山旺水合作開發的抗新冠病毒口服藥物VV116在一項對比“奈瑪特韋片/利托那韋片”(PAXLOVID)的Ⅲ期臨床研究中,達到方案預設的主要終點和次要有效性終點。與PAXLOVID相比,患者接受VV116治療的中位至持續臨床恢復時間更短,達到統計學優效。近期,君實生物將與監管部門溝通新藥上市申請事宜。
VV116是一款口服核苷類藥物,可抑制新冠病毒復制。這款在研新藥由中國科學院上海藥物研究所、中國科學院武漢病毒研究所、中國科學院新疆理化技術研究所、中國科學院中亞藥物研發中心/中烏醫藥科技城(科技部“一帶一路”聯合實驗室)、旺山旺水和君實生物共同研發。
兩家企業已在中國健康受試者中完成3項Ⅰ期研究,試驗結果顯示,VV116在健康受試者中表現出良好的安全性、耐受性和藥代動力學性質。2021年底,這款我國自主研發的新藥在烏茲別克斯坦獲得批准,用於治療中重度新冠肺炎患者。
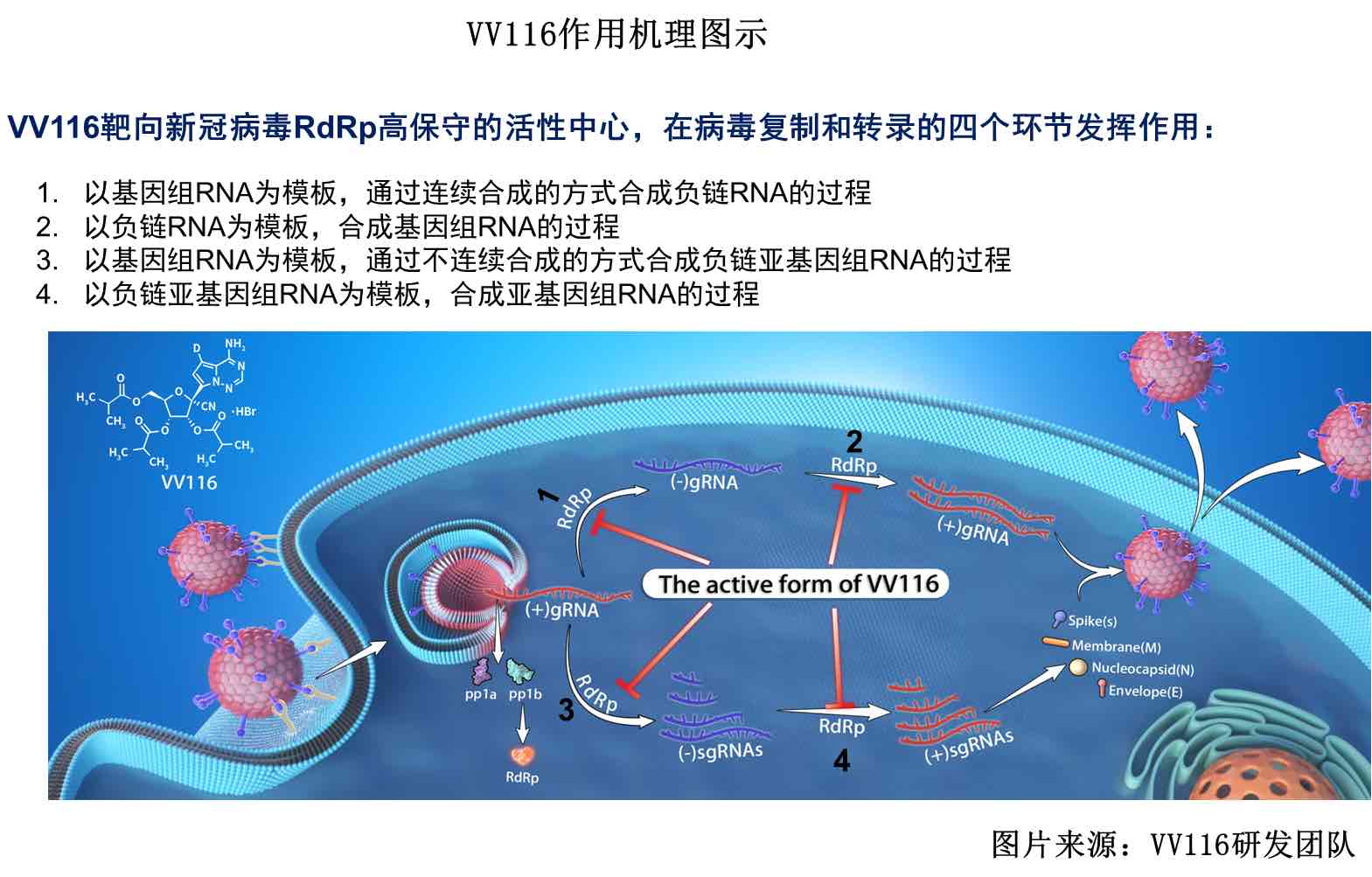
目前,圍繞VV116的多項國際多中心Ⅲ期臨床研究正在進行,如對比安慰劑、用於伴有進展為重症(包括死亡)的高風險患者的隨機、雙盲、國際多中心Ⅲ期臨床研究,以及多項針對輕中度和中重度新冠肺炎患者的臨床研究。
最近達到主要終點和次要有效性終點的,是一項多中心、單盲、隨機對照Ⅲ期臨床研究,旨在評價VV116對比PAXLOVID,用於輕中度新冠肺炎伴有進展為重症(包括死亡)的高風險患者早期治療的有效性和安全性。
PAXLOVID由輝瑞公司研發,是一款組合包裝的抗新冠病毒口服藥物,用於治療成人伴有進展為重症高風險因素的輕至中度新冠肺炎患者。這款新藥已在超過50個國家上市,今年2月獲得中國國家藥監局的應急附條件批准。
據介紹,這項對比研究實際入組822例患者,採用單盲設計,即在研究結束、最終數據庫鎖定前,研究者和申辦方都不知道具體的治療藥物分配情況。主要研究終點為“至持續臨床恢復的時間”,次要研究終點包括“截至第28天發生新冠肺炎進展(定義為進展為重症、危重症或全因死亡)的受試者百分比”“至持續臨床症狀消失的時間”“核酸檢測轉陰的受試者百分比”等。
臨床研究結果顯示,在方案預設的主要終點上,VV116組中位至持續臨床恢復時間更短,達到統計學優效,為“這一療法可加速新冠肺炎症狀緩解”提供了有力証據。在次要有效性終點上,VV116組和PAXLOVID組均未發生新冠肺炎疾病進展及死亡。
研究結果還顯示,兩組的至持續臨床症狀消失時間、至首次核酸檢測轉陰時間相似﹔與PAXLOVID相比,VV116組有統計學優效趨勢。在安全性方面,VV116總體安全性良好,總體不良事件發生率低於PAXLOVID。
君實生物表示,詳細的研究數據將在學術期刊上發布,公司期待VV116憑借良好的安全性和積極的早期療效,為我國疫情防控貢獻一份力量。
分享讓更多人看到 
相關新聞
- 評論
- 關注






















 第一時間為您推送權威資訊
第一時間為您推送權威資訊
 報道全球 傳播中國
報道全球 傳播中國
 關注人民網,傳播正能量
關注人民網,傳播正能量