上海企业“高强度赶工”申报新冠抗原检测产品,已获欧盟CE认证
截至目前,国家药监局已批准17个新冠病毒抗原检测试剂产品,还没有上海企业研发的产品获批上市。这是什么原因?解放日报·上观新闻记者采访后了解到,上海多家企业正在“高强度赶工”,走新冠抗原检测产品注册申报流程。其中,默禾医疗、伯杰医疗两家上海企业研发的新冠抗原检测试剂去年获得了欧盟CE认证。“我们公司生产的抗原检测产品已出口800万人份左右,但没有提前做好国内申报注册的准备。”默禾医疗董事长唐荣说。
上海产品获得欧盟市场准入资格
默禾医疗总部在上海国际医学园区的张江数字医疗基地,研发微生物检测、肿瘤检测和伴随诊断产品。去年1月,公司研发的新冠抗原检测试剂盒(胶体金法)获得欧盟CE认证,具备了欧盟市场准入条件,此后又获得英国MHRA认证,产品已出口到多个欧盟成员国以及日本、马来西亚等国家。这家企业还为国内外一些大企业代工,生产抗原检测产品。
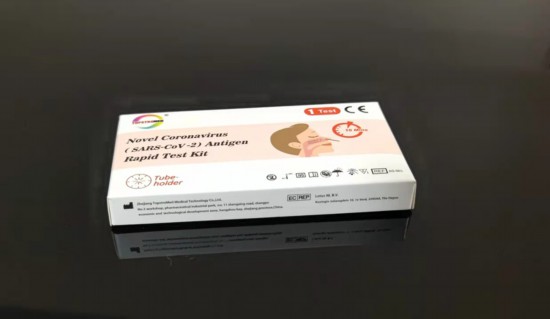
默禾医疗研发的新冠抗原检测试剂盒
沪研试剂盒的有效检出限相当于核酸检测试剂的33个CT,2分30秒就能出检测结果。“核酸检测是金标准,它的检测阈值是35个CT,我们的抗原检测试剂灵敏度接近这个金标准。”唐荣解释说,“国家药监局最近发布的新冠抗原检测试剂审评指导原则,要求15分钟内出检测结果,所以这个产品的检测速度是很快的。”
去年4月,伯杰医疗研发的新冠抗原检测试剂盒(胶体金法)也获得了欧盟CE认证。德国BIOMEX医学实验室出具的检测报告显示,这款试剂盒的灵敏度达到97.17%,特异性达到99.68%。检测速度方面,10—20分钟可检出结果。
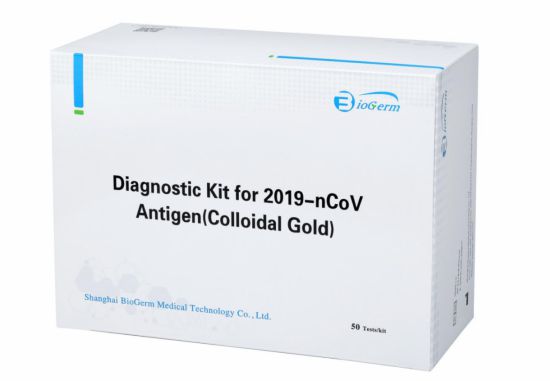
伯杰医疗研发的新冠抗原检测试剂盒
政府支持激励企业夜以继日工作
虽然沪研抗原检测产品已出口欧盟,但要在国内上市,还需要走完三类医疗器械注册证申报流程。3月12日,国务院联防联控机制综合组印发《新冠病毒抗原检测应用方案(试行)》后的第二天,上海国际医学园区管理部门就联系了默禾医疗,将公司研发、生产抗原检测产品的信息报给浦东新区科经委。“那天是星期六,没想到政府还在办公。”唐荣回忆,“那天下午,浦东新区药监局、科经委以及国家药监局医疗器械审评长三角分中心的工作人员就来我们公司现场办公,指导申报工作,上海市药监局的工作人员也联系了我们。”
看到政府部门这么抓紧时间,默禾医疗也铆足了劲。仅用一周时间,公司团队就撰写并补齐了抗原检测产品的体系材料和注册文件136件。平时整理好这些申报材料,往往需要几个月时间,但为了让上海产品早日在国内上市,公司团队夜以继日完成了材料准备工作。
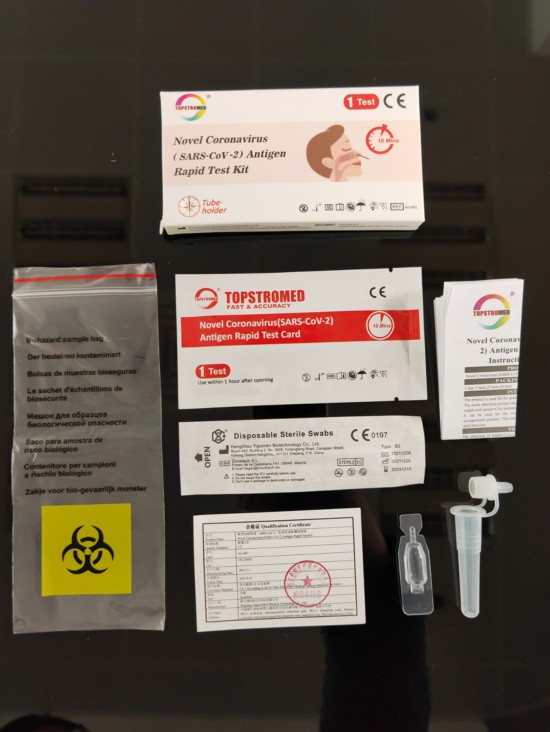
出口国外的新冠抗原检测试剂盒及其配件
本周,这家企业的任务是进行试生产。根据国家有关规定,企业要连续生产3个批次的医疗器械产品,随机抽取其中500—600份,送中国食品药品检定研究院进行检测,完成注册检流程。“听说有100多家企业在中检院排队送检,估计要等一段时间。”唐荣说,“我们已和有关部门沟通,争取早日走完这个流程,”
接下来,企业可能还要在国内开展临床试验,因为申报欧盟CE认证的临床试验是在国外做的,我国药监部门可能不承认。默禾医疗希望今后在临床试验上得到上海政府部门、上海市公卫中心等临床机构的支持,争取在一周内完成200例阳性、300例阴性的临床试验。
据介绍,这家企业的抗原检测试剂产能为100万人份/天,今后能扩产到500—1000万人份/天。今后如获批上市,这些产能就可以为国内基层医疗卫生机构、隔离观察人员和社区居民服务。
分享让更多人看到 
相关新闻
- 评论
- 关注






















 第一时间为您推送权威资讯
第一时间为您推送权威资讯
 报道全球 传播中国
报道全球 传播中国
 关注人民网,传播正能量
关注人民网,传播正能量