大江東︱新冠口服藥VV116獲批上市,一粒滬產新藥這樣誕生
走過三年艱辛,一朝終獲首肯——1月29日,經國家藥監局應急審評審批,1類創新藥民得維(VV116)附條件獲批上市了!
這是一款上海自主研發的口服小分子新冠病毒感染治療藥物,由中科院上海藥物所、上海君實生物等聯合研發,上海旺實生物醫藥科技有限公司持有,由上海迪賽諾生物醫藥有限公司作受托生產。這意味著,輕中度新型冠狀病毒感染(COVID-19)的成年患者,藥箱裡又多了一款“上海造”。
自2022年12月29日,VV116與帕羅韋德“頭對頭”對比試驗成果登頂醫學界頂尖學刊《新英格蘭醫學雜志》(NEJM)以來,這款國產自研新藥何時能用於臨床救治新冠患者,一直備受矚目。大江東工作室始終關注研發和審批進展,1月29日採訪了相關的專家及其團隊。
VV116,“這是他留給人間的最后一份禮物”
“這是國產自研的機制清楚、藥效明顯、安全性明確的抗新冠病毒藥物。感謝臨床團隊的努力和高效率。感念蔣華良院士為抗疫鞠躬盡瘁,這是他留給人間的最后一份禮物!”蔣院士生前好友、從美國歸來參與VV116開發的結構生物學家徐華強聞訊后很動感情。
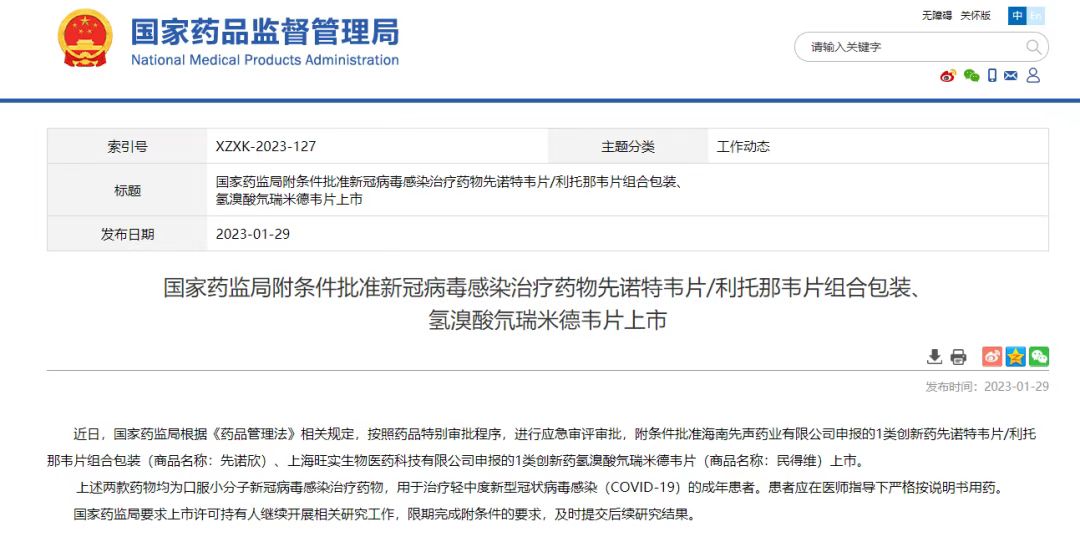
國家藥品監督局網站發布了VV116附條件獲批上市的信息
抗疫藥物一直是各科技大國抗疫的有力武器,是挽救生命、贏得國際聲望的必爭領域。基於自主研發藥物在全球抗疫中的重要地位,畢生致力於中國原創藥研究的著名藥學家、中科院院士蔣華良3年來帶領300名科研人員日夜攻關、焦首煎心,就在2022年12月23日上午,他還開了兩個小時緊張的線上協調會,籌備國產抗新冠藥物VV116藥品上市許可申報事宜。下午他在極度疲勞狀態下猝然離世。

蔣華良院士生前在實驗室工作。圖片來源:上海民盟微信公眾號
據徐華強回憶,2020年新冠疫情爆發后,蔣華良院士召集所裡的課題組,請大家把手頭的課題都先放一放,一起攻關這一關乎全世界人民健康的緊急難題。1月19日,中科院上海藥物所成立抗疫攻關小組,300多位科研人員放棄假期,發揮各自科研優勢,聯手攻關。
一周后,蔣華良院士與清華大學饒子和院士領導的攻關團隊在全世界率先測定新冠病毒3CL水解酶(Mpro)高分辨率晶體結構,並將這一結構毫無保留地向世界公開。
知道病毒長什麼樣了,下一步就要搞清楚它是如何復制的?如何突破人體的免疫防線?怎樣才能限制它的復制?
“我們在研究中發現,RNA復制酶作為新冠病毒轉錄復制的核心組件,其功能在病毒變異中高度保守,如果能把病毒的RNA復制酶限制住,活性降低了,那麼不管它怎麼變異,都很難在人體內復制、存活。我們發現,具有抗病毒活性的核苷類藥物,在抑制新冠RNA復制酶上同樣有效。”徐華強說。
經過46天日夜奮戰,徐華強團隊成功解析新冠肺炎病毒RNA復制酶單獨結構以及結合RNA和抑制劑瑞德西韋復合物的冷凍電鏡結構,闡述瑞德西韋等核苷類藥物抗病毒的精細機制,該成果2020年5月發表於國際頂刊《科學》上。
中科院上海藥物所沈敬山團隊研究核苷類藥物近20年,徐華強團隊的成果為他們送來了重要的作戰線路圖,“相當於把新冠病毒的可能靶標找出來了,把‘鎖’畫出來了,提供給沈敬山團隊去尋找開鎖的鑰匙。”
沈敬山團隊在100多種候選小分子化合物中,夜以繼日地試驗、篩選,終於找到了幾種候選藥物,進而又進行改良,把通常作注射劑狀的藥物改良為口服藥物。“主要是根據新冠病毒攻擊人體上呼吸道、肺部的特點,進行藥物改良。”
2021年11月,VV116獲批在國內啟動臨床試驗,並於2022年1月23日完成了I期臨床試驗,結果表明VV116不良事件發生率與安慰劑組相當,意味著具有良好的安全性和耐受性。而在烏茲別克斯坦完成的II臨床試驗,比較了VV116和當地批准的標准治療(法匹拉韋)的療效和安全性。結果証明VV116可以顯著降低進展為危重型或全因死亡的風險,保護率為92%。基於此,VV116於2021年12月在烏茲別克斯坦獲批上市。
科研成果多次登頂國際學刊,為何是“附條件”獲批上市?
在大上海保衛戰期間,由上海交通大學醫學院附屬瑞金醫院院長寧光院士與趙任教授牽頭,聯合上海7家新冠治療定點醫院共同完成了VV116與帕羅韋德“頭對頭”對比試驗。其結果表明,對於有高危因素的輕中度新冠成人患者,在至持續臨床康復時間方面,國產新冠藥物VV116是4天,帕羅韋德是5天,服用VV116恢復更快,且VV116的不良事件更少。
該研究論文於2022年12月29日在臨床醫學國際頂尖期刊《新英格蘭醫學雜志》(NEJM)發表,是全球首個與帕羅韋德頭對頭臨床研究成果,也是首個國產抗新冠藥物臨床研究成果在NEJM發表。此項研究的試驗設計、研究方法、研究質量及研究結果得到國際醫藥界的一致認可。
可以說,VV116整個研發過程成果頻出,並數次登頂國際頂尖學刊。盡管對照國家新藥上市標准,目前VV116的對照組實驗及三期臨床實驗規模確實存在“不達標”短板。但有專家提請注意,帕羅韋德和莫諾拉韋(Molnupiravir)在中國亦尚未開展藥品上市必須的三期臨床試驗。事實上,這兩款藥在美國亦是緊急授權獲批上市。
寧光院士感謝所有參加研究的7家醫院,認為VV116具備了附條件上市的安全性和有效性基本條件,准予VV116獲批附條件上市,有助於解決目前臨床救治用藥短缺的緊迫問題。應對來勢洶洶的新冠疫情,緊急授權新藥附帶條件上市,亦是符合藥品監管的國際通行做法。
諸多專家的共識是,國家在和病毒打一場生死之仗,我們手頭有了“彈藥”緊急使用,有助於有效應對新冠病毒變異株,守護人民健康。

近日,在上海市閔行區顓橋社區衛生服務中心,醫務科科長王莉芸(右)與護理院工作人員核對新冠小分子藥配送清單。王翔 攝
所有同道全力以赴,每一個微小的成功,都是向戰勝病毒再進一步
新藥研發,極其不易,素有耗時十年、耗資十億元的說法。VV116能在三年裡順利破殼出鞘,得到了來自全國醫學科研力量的支持。
一粒新藥的誕生,依靠的是國家蒸蒸日上的研究實力。新藥終於從上海的實驗室出發,走向了全國的醫院。
自2022年10月起,由浙江大學傳染病診治國家重點實驗室主任李蘭娟院士牽頭的一項多中心、雙盲、隨機、安慰劑對照的III期臨床研究,開始緊鑼密鼓地推進。這項研究旨在評價VV116在伴或不伴有進展為重症高風險因素的輕中度COVID-19患者中的有效性和安全性。
李蘭娟院士說:“從10月21日首例患者篩選開始,全國30多家醫學中心克服了重重困難,在積極救治患者、防重症、降死亡率的同時,不到3個月,便快速、高效地完成了1300多例輕中度新型冠狀病毒感染者的入組。”
目前該研究已完成方案預設的期中分析,結果顯示:在有效性方面,與安慰劑組相比,接受VV116治療的患者,至持續臨床症狀消失的時間和臨床症狀緩解的時間均顯著縮短,新冠病毒Ct值的上升速度及病毒載量的下降速度也明顯快於安慰劑組﹔在安全性方面,VV116治療組在治療期間不良事件的發生率低,與安慰劑組相當。VV116以其良好的療效與安全性表現,有望成為治療新型冠狀病毒感染(COVID-19)的一線藥物之一,而且輕中度新型冠狀病毒感染普通患者和存在重症高風險因素的患者均可獲益。
李蘭娟院士表示,VV116的上市,能讓更多新型冠狀病毒感染者得到有效的抗病毒治療,降低疫情傳播風險,並在一定程度上減少重症發生,最大程度保護人民群眾生命安全。
另一項由國家傳染病醫學中心(上海)主任,復旦大學附屬華山醫院感染科主任張文宏教授領銜的臨床試驗也正在進行中,主要入組有高風險因素(肥胖、高血壓、慢性肺病等)的輕型和普通型患者,研究也將為該藥物保護脆弱人群進一步提供全面的數據。
該團隊早在2022年5月與上海公共衛生臨床中心、臨港實驗室共同合作,完成了一項開放性、前瞻性隊列研究,評估VV116對非重症奧密克戎感染者核酸轉陰時間的影響,相關成果於2022年5月18日發表在 Emerging Microbes & Infections 雜志。研究數據提示,在使用VV116的奧密克戎感染者中,從開始用藥到核酸轉陰的平均天數為3.52天﹔在首次核酸檢測陽性5日內使用VV116的患者中,其核酸從首次檢測陽性到轉陰的平均時間為8.56天,小於對照組的11.13天。在藥物安全性上,使用了VV116的患者中,未觀察到嚴重不良反應。
張文宏教授表示,“這些研究結果顯示,VV116對新冠肺炎療效確切,安全性更具優勢,對我國感染者也更具可及性。它的上市將在新冠疫情的第二、第三波來襲時發揮作用,為可能向重症轉化的風險人群提供了有力武器。”
醫藥產業人士指出,掌握大量臨床用藥數據也是藥品研發關鍵,國產抗新冠藥物具有價格相對便宜、生產原料可控、推廣便利、臨床數據便於獲取等優勢,如能盡快大規模用於臨床救治,既能讓老百姓負擔得起、用上放心藥,也能收集更多的臨床用藥數據,為我國抗疫積累寶貴的臨床經驗。
在大上海保衛戰期間,趙任教授和寧光院士領銜指揮團隊,連續3個多月駐守醫院運管指揮中心,白天進行全院人員、物資、設備、空間等所有醫療資源的統籌調配﹔每天晚上科研討論如期舉行,每晚8點的VV116臨床試驗進展線上會雷打不動。
“正是所有同道全力以赴,我們才能順利完成這項研究。”寧光院士說,“我們瑞金醫院的醫者始終相信,我們每一次的成功,哪怕是再微小也是向戰勝病毒又跨出一步。科學方法不斷進步,科學精神永遠不變,即在批判和質疑中追求科學真諦﹔在實踐和實証中獲得科學靈感﹔在定量和定性分析中建立科學方法﹔在獨立和包容中擴展科學內涵﹔在孤獨和獻身中堅持科學精神﹔在欣喜和靜謐中享受科學快樂。”
(來源:人民日報中央廚房-大江東工作室)
分享讓更多人看到 
相關新聞
- 評論
- 關注






















 第一時間為您推送權威資訊
第一時間為您推送權威資訊
 報道全球 傳播中國
報道全球 傳播中國
 關注人民網,傳播正能量
關注人民網,傳播正能量